![]() Libtayo reçoit une approbation complète dans le carcinome basocellulaire localement avancé (CBC) et une approbation accélérée dans le CBC métastatique, suite à son examen prioritaire par la FDA.
Libtayo reçoit une approbation complète dans le carcinome basocellulaire localement avancé (CBC) et une approbation accélérée dans le CBC métastatique, suite à son examen prioritaire par la FDA.
![]() Libtayo est désormais approuvé pour le traitement des deux cancers de la peau au stade avancé les plus fréquents aux États-Unis.
Libtayo est désormais approuvé pour le traitement des deux cancers de la peau au stade avancé les plus fréquents aux États-Unis.
La Food and Drug Administration (FDA) des États-Unis a approuvé l’inhibiteur de PD-1 Libtayo® (cemiplimab-rwlc), qui devient le premier médicament d’immunothérapie indiqué pour le traitement des patients atteints d’un carcinome basocellulaire (CBC) avancé ayant déjà été traités par un inhibiteur de la voie Hedgehog ou auxquels un inhibiteur de la voie Hedgehog ne convient pas. Une approbation complète a été accordée pour les patients atteints de CBC localement avancé et une approbation accélérée a été accordée pour les patients atteints de CBC métastatique.
« Le pronostic des patients porteurs d’une forme avancée de carcinome basocellulaire est très réservé », précise Peter Adamson, Responsable, Développement global, Oncologie et Innovation en pédiatrie, de Sanofi. « Grâce à la participation et au soutien de chercheurs, cliniciens et patients partout dans le monde, nous sommes fiers de proposer aujourd’hui cette nouvelle option d’immunothérapie aux patients des États-Unis atteints d’un carcinome basocellulaire au stade avancé, qui est une forme de cancer de la peau non-mélanome aux conséquences dévastatrices. Avec Regeneron, nous continuons de développer Libtayo dans plusieurs indications et dans le cadre de divers essais cliniques, en monothérapie et en association avec plusieurs autres approches thérapeutiques, afin de proposer des options thérapeutiques significatives aux patients présentant des besoins médicaux non satisfaits importants. »
Libtayo est le premier médicament ayant apporté un bénéfice clinique à cette catégorie de patients selon les résultats d’un essai pivot. L’approbation complète dans le CBC localement avancé est basée sur l’analyse primaire de l’essai ; l’approbation accélérée dans le CBC métastatique est basée sur une analyse intermédiaire montrant l’impact de Libtayo sur le taux de réponse tumorale et la durabilité de la réponse. Le maintien de l’approbation dans le CBC métastatique peut dépendre de données supplémentaires provenant de l’essai vérifiant le bénéfice clinique.
« L’approbation de Libtayo par la FDA va modifier le paradigme thérapeutique pour les patients porteurs d’un carcinome basocellulaire au stade avancé », souligne le docteur Karl Lewis, professeur de médecine à la Division d’oncologie médicale de l’Université du Colorado et investigateur de l’étude. « Le carcinome basocellulaire au stade avancé est un cancer persistant et douloureux pouvant causer une défiguration importante. Les principales options de traitement systémique sont les inhibiteurs de la voie Hedgehog, mais chez de nombreux patients la maladie continue d’évoluer ou devient résistante à cette forme de traitement. Avec Libtayo, ces patients bénéficient désormais d’un nouveau médicament d’immunothérapie qui a montré des réponses antitumorales durables et cliniquement significatives. »
L’approbation aux États-Unis porte à deux les indications thérapeutiques de Libtayo et fait suite à une évaluation prioritaire de la FDA, une procédure qui, si approuvée, est réservée aux médicaments représentant une amélioration significative en termes de sécurité ou d’efficacité pour le traitement de maladies graves. En 2018, Libtayo est devenu le premier médicament à visée systémique approuvé pour les adultes atteints d’un cancer épidermoïde cutané (CEC) métastatique ou localement avancé qui ne sont pas candidats à une chirurgie curative ni à une radiothérapie curative. Des effets indésirables à médiation immunitaire, qui peuvent être graves ou mortels, peuvent survenir dans tout système organique ou tissu pendant ou après le traitement par Libtayo.
Le CBC est le cancer de la peau le plus fréquent aux États-Unis où près de deux millions de nouveaux cas sont diagnostiqués chaque année. Bien que la grande majorité des carcinomes basocellulaires soient diagnostiqués tôt et traités avec succès par chirurgie ou radiothérapie, une petite proportion des tumeurs peuvent atteindre un stade avancé et pénétrer plus profondément dans les tissus (stade localement avancé) ou se propager à d’autres organes (forme métastatique), ce qui les rend plus difficiles à traiter.
« Avec l’approbation d’aujourd’hui, Libtayo est désormais approuvé pour le traitement des formes avancées à la fois du cancer épidermoïde cutané et du cancer basocellulaire et consolide notre présence dans la sphère de la dermato-oncologie », précise le docteur Israel Lowy, Ph.D., Senior Vice-Président, Sciences translationnelles et cliniques de Regeneron. « Outre les cancers de la peau, nous poursuivons nos recherches sur le potentiel de Libtayo dans le traitement d’autres cancers difficiles à traiter, à commencer par le cancer du poumon non à petites cellules pour lequel une décision de la FDA est attendue à la fin du mois de février. »
L’approbation de Libtayo par la FDA a pris appui sur les résultats d’un essai multicentrique de phase II en ouvert et non randomisé ayant recruté des patients porteurs d’un CBC localement avancé non résécable ou d’un CBC métastatique (métastases ganglionnaires ou à distance). Il s’agit de l’essai clinique prospectif ayant recruté le plus grand nombre de patients présentant ces caractéristiques (n=132) ; 112 patients ont été pris en compte dans l’analyse d’efficacité. Les patients des deux cohortes avaient présenté une progression sous inhibiteur de la voie Hedgehog (HHI) ou n’avaient pas présenté de réponse objective après 9 mois de traitement par HHI ou, encore, étaient intolérants au traitement antérieur par HHI.
Le critère d’efficacité principal était une réponse objective confirmée (ORR) et l’un des principaux critères d’efficacité secondaires était la durée de la réponse, évaluée par un comité central indépendant.
Les résultats d’efficacité des patients traités par Libtayo 350 mg toutes les trois semaines se sont établis comme suit :
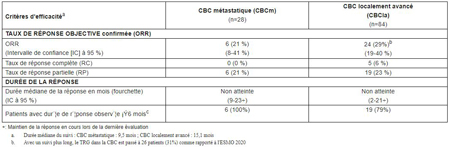
Chez les patients dont les données de sécurité ont pu être évaluées (n=132), les réactions indésirables les plus fréquemment rapportées (au moins 15 % des patients) ont été la fatigue, les douleurs musculosquelettiques, la diarrhée, les éruptions cutanées, le prurit et les infections des voies respiratoires supérieures. Des réactions indésirables graves ont été observées chez 32 % des patients ; celles observées chez au moins deux patients ont été les suivantes : infection des voies urinaires, colite, insuffisance rénale aiguë, insuffisance surrénalienne, anémie, néoplasme infecté et somnolence. Des réactions indésirables ayant entraîné l’arrêt définitif du traitement ont été observées chez 13 % des patients, les plus fréquentes (observées chez au moins deux patients) ayant été la colite et une détérioration de l’état de santé général.
Libtayo est un anticorps monoclonal entièrement humain qui se lie au récepteur de checkpoint immunitaire PD-1 (récepteur-1 de mort cellulaire programmée) sur les lymphocytes T. Sa liaison au récepteur PD-1 permet d’empêcher les cellules tumorales d’emprunter le voie PD-1 et donc d’inhiber la fonction des lymphocytes T.
La dose recommandée de Libtayo est de 350 mg, administrée par voie intraveineuse pendant 30 minutes toutes les trois semaines, jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable. Libtayo est proposé en flacon unidose de 350 mg. Aucune recherche des biomarqueurs PD-L1 ou de la charge mutationnelle tumorale n’est nécessaire avec de débuter le traitement par Libtayo dans l’indication carcinome basocellulaire au stade avancé.
Aux États-Unis, la dénomination générique de Libtayo dans son indication approuvée est cemiplimab-rwlc, le suffixe « rwlc » ayant été attribué conformément à la nomenclature publiée par la Food and Drug Administration des États-Unis (Nonproprietary Naming of Biological Products Guidance for Industry). En dehors des États-Unis, la dénomination générique de Libtayo, dans son indication approuvée, est cemiplimab.
Libtayo fait l’objet d’un examen prioritaire de la FDA pour le traitement du cancer du poumon non à petites cellules exprimant ¡Ý50 % de cellules tumorales PD-L1 positives et devrait faire connaître sa réponse le 28 février 2021. L’Agence européenne des médicament (EMA) évalue Libtayo dans le traitement du CPNPC au stade avancé exprimant ¡Ý50 % de cellules tumorales PD-L1 positives et du CBC localement avancé aprés un traitement par inhibiteur de la voie Hedgehog. Les décisions de la Commission européenne sont attendues au deuxième semestre de 2021.
Le programme clinique étendu consacré à Libtayo porte sur des cancers difficiles à traiter. Pour le cancer de la peau, il s’agit d’essais sur le traitement adjuvant et néoadjuvant du CEC. Libtayo est également évalué dans le cadre d’essais pivots dans le traitement du CPNPC (en association avec une chimiothérapie) et du cancer du col de l’utérus, ainsi qu’en association avec de nouvelles approches thérapeutiques dans le traitement de tumeurs solides et de cancers hématologiques. Ces utilisations potentielles sont encore expérimentales et aucun organisme de réglementation ne les a encore pleinement évaluées.
Libtayo est développé conjointement par Sanofi et Regeneron dans le cadre d’un accord de collaboration global.