![]() Paiement d’étape de 8 millions d’euros reçu pour le démarrage de l’étape d’expansion de la phase 1 de BI 765063, anti-SIRPα (sur l’axe CD47/SIRPa), menée dans les tumeurs solides avec son partenaire Boehringer Ingelheim, après les résultats positifs de l’étape d’escalade de dose du produit.
Paiement d’étape de 8 millions d’euros reçu pour le démarrage de l’étape d’expansion de la phase 1 de BI 765063, anti-SIRPα (sur l’axe CD47/SIRPa), menée dans les tumeurs solides avec son partenaire Boehringer Ingelheim, après les résultats positifs de l’étape d’escalade de dose du produit.
Paiement d’étape de 5 millions d’euros reçu au démarrage d’un essai clinique de phase 2 avec OSE-127/S95011 dans le syndrome de Sjögren avec son partenaire Servier, promoteur de cet essai.
Paiement à la signature de 7 millions d’euros de son partenaire Veloxis Pharmaceuticals Inc., suite à la licence accordée sur le produit FR104, anti-CD28, dans le domaine de la greffe, complété par un nouveau paiement d’étape de 5 millions d’euros reçu en 2022 suite à l’obtention d’un Investigational New Drug (IND) aux Etats-Unis.
Chiffre d’affaires de 26 millions d’euros lié aux partenariats pharmaceutiques et position de trésorerie de 33,6 millions d’euros au 31 décembre 2021, contre 29,4 millions d’euros au 31 décembre 2020.
OSE Immunotherapeutics SA annonce ses résultats financiers annuels au 31 décembre 2021 et fait le point sur les avancées cliniques et les perspectives 2022 de la Société pour ses immunothérapies en Immuno-Oncologie et Immuno-Inflammation.
Dominique Costantini, Directrice générale commente : « La société dispose d’un portefeuille de produits diversifié et s’appuie sur plusieurs accords de partenariats, ce qui est un atout très important pour des avancées cliniques prévues dans de multiples indications.
Nous sommes très fiers des progrès d’OSE avec, tout d’abord, les résultats de l’essai de phase 3 Tedopi® qui a montré des bénéfices significatifs de survie versus un traitement de chimiothérapie. Les patients de l’essai souffrant d’un cancer du poumon non à petites cellules en résistance secondaire étaient en échec aux traitements par checkpoint inhibiteurs donnés en deuxième ligne, une population de patients difficiles à traiter et à fort besoin médical. Sur la base de ces résultats, nous préparons un dossier d’accès précoce qui sera proposé aux Agences réglementaires en 2022, et nous leur présenterons également un projet d’essai additionnel de phase 3 en résistance secondaire après échec d’un checkpoint inhibiteur, cette fois en première ligne de traitement, une indication devenue la plus fréquente, mais toujours à fort besoin médical.
Nous avons également annoncé, financées par notre partenaire Boehringer Ingelheim, les avancées cliniques du produit BI765063 anti-SIRPα dans un essai d’expansion en cours dans des tumeurs solides, suite aux résultats prometteurs de l’étude de phase 1 menée en monothérapie et en combinaison avec le produit anti-PD1 de notre partenaire.
L’avancée en phase 2 du produit OSE-127, anti-IL-7R, dans la maladie de Sjögren, via notre partenaire Servier, se poursuit en parallèle de l’essai de phase 2 mené par OSE dans la rectocolite hémorragique.
Nous avons également reçu un paiement d’étape de 5 millions d’euros pour une autorisation d’IND permettant le développement clinique aux Etats-Unis, obtenue par notre nouveau partenaire Veloxis qui développera le produit FR104, anti-CD28, dans le domaine de la greffe.
Sur la plateforme épitopes, nous avons obtenu en clinique une réponse T mémoire positive à long terme avec CoVepiT, vaccin T anti-COVID multi-cibles, et nous prévoyons d’optimiser les peptides les plus pertinents pour pouvoir être prêts face à une autre vague pandémique liée à un nouveau variant préoccupant.
La combinaison de ces progrès en matière de développement clinique et de ces résultats financiers renforcent notre confiance en l’avenir. Nous avons des nouveaux projets d’innovation « First-in-Class » en R&D et nous poursuivrons cette politique d’accords de licence qui assure un développement large et des revenus récurrents. »
Au 31 décembre 2021, le chiffre d’affaires de la Société est de 26 millions d’euros, essentiellement lié aux accords de licences et aux paiements d’étapes.
Les principales dépenses sont en R&D et représentent 75 % du total des dépenses de la Société.
Au 31 décembre 2021, la position de trésorerie de la Société s’élevait à 33,6 millions d’euros contre 29,4 millions d’euros au 31 décembre 2020. Compte tenu de ses programmes actuels de développement clinique et de R&D, la Société estime que sa trésorerie devrait lui permettre de financer ses activités jusqu’au premier trimestre de 2023 sans intégrer d’autres revenus de nouveaux accords de licence et de crédit d’impôt recherche.
Faits marquants 2021 :
Tedopi®, combinaison de 10 néo-épitopes pour une activation spécifique des lymphocytes T : Résultats positifs finaux de la phase 3 en résistance secondaire dans le cancer du poumon non à petites cellules, après échec de checkpoint inhibiteurs donnés en deuxième ligne ;
Démarrage de deux phases 2 en combinaison avec un checkpoint inhibiteurs avec des études sponsorisées par des groupes d’investigateurs.
![]() Résultats positifs finaux de l’essai clinique de phase 3 de Tedopi®, ‘Atalante-1’, présentés au congrès 2021 de l’ESMO (European Society for Medical Oncology). Les données en résistance secondaire ont montré une survie globale significativement améliorée par rapport à une chimiothérapie (docetaxel /pemetrexed) un ratio bénéfice/risque favorable et une bonne qualité de vie chez des patients atteints d’un cancer du poumon non à petites cellules, en résistance secondaire aux checkpoints inhibiteurs immunitaires donnés en deuxième ligne.
Résultats positifs finaux de l’essai clinique de phase 3 de Tedopi®, ‘Atalante-1’, présentés au congrès 2021 de l’ESMO (European Society for Medical Oncology). Les données en résistance secondaire ont montré une survie globale significativement améliorée par rapport à une chimiothérapie (docetaxel /pemetrexed) un ratio bénéfice/risque favorable et une bonne qualité de vie chez des patients atteints d’un cancer du poumon non à petites cellules, en résistance secondaire aux checkpoints inhibiteurs immunitaires donnés en deuxième ligne.
![]() En août, randomisation de la première patiente dans la phase 2 clinique ‘TEDOVA » dans le cancer de l’ovaire, promue et menée par ARCAGY-GINECO. Cette étude vise à évaluer Tedopi® en traitement de maintenance, seul ou en combinaison avec un checkpoint inhibiteur immunitaire anti-PD-1, Keytruda® (pembrolizumab), versus le traitement de référence chez des patientes atteintes d’un cancer de l’ovaire en situation de première ou de deuxième rechute platine sensible, dont la maladie est contrôlée après chimiothérapie avec platine et ayant déjà reçu un traitement par bevacizumab et inhibiteur de PARP.
En août, randomisation de la première patiente dans la phase 2 clinique ‘TEDOVA » dans le cancer de l’ovaire, promue et menée par ARCAGY-GINECO. Cette étude vise à évaluer Tedopi® en traitement de maintenance, seul ou en combinaison avec un checkpoint inhibiteur immunitaire anti-PD-1, Keytruda® (pembrolizumab), versus le traitement de référence chez des patientes atteintes d’un cancer de l’ovaire en situation de première ou de deuxième rechute platine sensible, dont la maladie est contrôlée après chimiothérapie avec platine et ayant déjà reçu un traitement par bevacizumab et inhibiteur de PARP.
![]() En novembre, randomisation du premier patient dans la phase 2 clinique dans le cancer du poumon non à petites cellules, promue et menée par FoRT, une fondation italienne en oncologie. Cette étude vise à évaluer Tedopi® en combinaison avec un checkpoint inhibiteur, Opdivo® (nivolumab), versus Tedopi® en combinaison avec une chimiothérapie, versus une chimiothérapie seule en seconde ligne de traitement chez des patients atteints d’un cancer du poumon non à petites cellules, après une première ligne de chimio-immunothérapie.
En novembre, randomisation du premier patient dans la phase 2 clinique dans le cancer du poumon non à petites cellules, promue et menée par FoRT, une fondation italienne en oncologie. Cette étude vise à évaluer Tedopi® en combinaison avec un checkpoint inhibiteur, Opdivo® (nivolumab), versus Tedopi® en combinaison avec une chimiothérapie, versus une chimiothérapie seule en seconde ligne de traitement chez des patients atteints d’un cancer du poumon non à petites cellules, après une première ligne de chimio-immunothérapie.
![]() Phase 2 clinique en cours dans le cancer du pancréas, ‘TEDOPaM’, promue et menée par le groupe coopérateur en oncologie GERCOR : en raison de la pandémie COVID-19, le recrutement de nouveaux patients avait été suspendu temporairement en mars 2020 et après une revue des données collectées avant fin mars 2020 selon le protocole initial (Tedopi® seul ou en combinaison avec Opdivo® ou seul ou versus chimiothérapie par FOLFIRI), les inclusions ont repris au 2ème trimestre 2021 selon un protocole amendé comparant Tedopi® en combinaison avec FOLFIRI versus FOLFIRI, après traitement par FOLFIRINOX.
Phase 2 clinique en cours dans le cancer du pancréas, ‘TEDOPaM’, promue et menée par le groupe coopérateur en oncologie GERCOR : en raison de la pandémie COVID-19, le recrutement de nouveaux patients avait été suspendu temporairement en mars 2020 et après une revue des données collectées avant fin mars 2020 selon le protocole initial (Tedopi® seul ou en combinaison avec Opdivo® ou seul ou versus chimiothérapie par FOLFIRI), les inclusions ont repris au 2ème trimestre 2021 selon un protocole amendé comparant Tedopi® en combinaison avec FOLFIRI versus FOLFIRI, après traitement par FOLFIRINOX.
![]() Des nouveaux brevets renforcent la propriété intellectuelle de Tedopi®
Des nouveaux brevets renforcent la propriété intellectuelle de Tedopi®
![]() Septembre 2021 : accord de délivrance par l’Office américain des brevets et des marques d’un brevet protégeant l’induction d’une réponse précoce des lymphocytes T mémoires dans l’utilisation de Tedopi® dans le traitement du cancer du poumon non à petites cellules chez les patients HLA-A2 positifs.
Septembre 2021 : accord de délivrance par l’Office américain des brevets et des marques d’un brevet protégeant l’induction d’une réponse précoce des lymphocytes T mémoires dans l’utilisation de Tedopi® dans le traitement du cancer du poumon non à petites cellules chez les patients HLA-A2 positifs.
![]() Octobre 2021 : accord de délivrance par l’Office européen des brevets d’un brevet protégeant le procédé de fabrication d’une émulsion prête à l’emploi ("ready-to-use") de Tedopi® pour son utilisation dans le traitement des cancers chez les patients HLA-A2 positifs.
Octobre 2021 : accord de délivrance par l’Office européen des brevets d’un brevet protégeant le procédé de fabrication d’une émulsion prête à l’emploi ("ready-to-use") de Tedopi® pour son utilisation dans le traitement des cancers chez les patients HLA-A2 positifs.
![]() Janvier 2022 : accord de délivrance par l’Office japonais des brevets d’un brevet protégeant l’utilisation de Tedopi® après échec d’un traitement par checkpoint inhibiteur chez des patients HLA-A2 positifs atteints d’un cancer.
Janvier 2022 : accord de délivrance par l’Office japonais des brevets d’un brevet protégeant l’utilisation de Tedopi® après échec d’un traitement par checkpoint inhibiteur chez des patients HLA-A2 positifs atteints d’un cancer.
BI 765063 (OSE-172), checkpoint inhibiteur myéloïde développé en partenariat avec Boehringer Ingelheim : Phase 1 clinique : des résultats prometteurs de la phase d’escalade de dose et phase d’expansion en cours
![]() Les données d’escalade de dose (Etape 1) de l’essai de phase 1 présentées à l’ASCO en juin et à l’ESMO en septembre de BI 765063 en monothérapie et en combinaison avec l’anti-PD-1 BI 745091 (ezabenlimab) montrent une bonne tolérance du produit et une activité clinique prometteuse, dont une réponse partielle en monothérapie et trois réponses partielles en combinaison chez des patients atteints de tumeurs solides avancées et lourdement prétraités.
Les données d’escalade de dose (Etape 1) de l’essai de phase 1 présentées à l’ASCO en juin et à l’ESMO en septembre de BI 765063 en monothérapie et en combinaison avec l’anti-PD-1 BI 745091 (ezabenlimab) montrent une bonne tolérance du produit et une activité clinique prometteuse, dont une réponse partielle en monothérapie et trois réponses partielles en combinaison chez des patients atteints de tumeurs solides avancées et lourdement prétraités.
![]() En septembre 2021, traitement du premier patient dans la phase d’expansion de l’essai clinique de phase 1 évaluant BI 765063 en combinaison avec l’anti-PD-1 BI 745091 (ezabenlimab), chez des patients atteints d’un cancer avancé MSS (Microsatellite Stable) de l’endomètre ou colorectal. Le traitement de ce premier patient a déclenché un paiement d’étape de 8 millions d’euros de Boehringer Ingelheim à OSE Immunotherapeutics.
En septembre 2021, traitement du premier patient dans la phase d’expansion de l’essai clinique de phase 1 évaluant BI 765063 en combinaison avec l’anti-PD-1 BI 745091 (ezabenlimab), chez des patients atteints d’un cancer avancé MSS (Microsatellite Stable) de l’endomètre ou colorectal. Le traitement de ce premier patient a déclenché un paiement d’étape de 8 millions d’euros de Boehringer Ingelheim à OSE Immunotherapeutics.
OSE-127, anticorps monoclonal ciblant le récepteur IL-7, développé en partenariat avec Servier : démarrage d’une phase 2 dans le syndrome de Sjögren (sponsor Servier) ; poursuite de la phase 2 clinique en cours dans la rectocolite hémorragique (sponsor OSE) suite à la revue des résultats de l’analyse de futilité fin décembre 2021
![]() En août 2021, inclusion du premier patient dans l’essai de phase 2 évaluant l’efficacité et la tolérance d’OSE-127/S95011 dans le syndrome de Sjögren (promotion Servier). L’inclusion de ce premier patient a déclenché un paiement d’étape de 5 millions d’euros de Servier à OSE Immunotherapeutics.
En août 2021, inclusion du premier patient dans l’essai de phase 2 évaluant l’efficacité et la tolérance d’OSE-127/S95011 dans le syndrome de Sjögren (promotion Servier). L’inclusion de ce premier patient a déclenché un paiement d’étape de 5 millions d’euros de Servier à OSE Immunotherapeutics.
![]() En décembre 2021, à la suite de la revue des résultats d’efficacité et de tolérance prévus à l’analyse de futilité, recommandation du Comité indépendant d’experts scientifiques (IDMC, « Independant Data Monitoring Committee ») de poursuivre l’étude de phase 2 d’OSE-127 dans la rectocolite hémorragique (promotion OSE).
En décembre 2021, à la suite de la revue des résultats d’efficacité et de tolérance prévus à l’analyse de futilité, recommandation du Comité indépendant d’experts scientifiques (IDMC, « Independant Data Monitoring Committee ») de poursuivre l’étude de phase 2 d’OSE-127 dans la rectocolite hémorragique (promotion OSE).
![]() Présentation des premières données précliniques d’efficacité d’OSE-127 dans des modèles PDX (Patient- Derived Xenograft) de leucémie aiguë lymphoblastique (LAL) à précurseurs B au congrès annuel de l’ASH (American Society of Hematology) en décembre 2021.
Présentation des premières données précliniques d’efficacité d’OSE-127 dans des modèles PDX (Patient- Derived Xenograft) de leucémie aiguë lymphoblastique (LAL) à précurseurs B au congrès annuel de l’ASH (American Society of Hematology) en décembre 2021.
FR104, anticorps monoclonal antagoniste de CD28 : accord de licence avec Veloxis Pharmaceuticals Inc., dans la transplantation ; autorisation d’essai clinique et désignation et ‘fast-track‘ aux États-Unis.
![]() En avril 2021, signature d’un accord de licence qui concède à Veloxis les droits mondiaux pour développer, fabriquer et commercialiser FR104 dans toutes les indications de transplantation. Selon cet accord, la Société pourra recevoir jusqu’à 315 millions d’euros de Veloxis en paiements d’étapes potentiels, dont un paiement de 7 millions d’euros versé à la signature, ainsi que des redevances échelonnées sur les futures ventes potentielles. OSE conserve tous les droits dans les indications de maladie auto-immune.
En avril 2021, signature d’un accord de licence qui concède à Veloxis les droits mondiaux pour développer, fabriquer et commercialiser FR104 dans toutes les indications de transplantation. Selon cet accord, la Société pourra recevoir jusqu’à 315 millions d’euros de Veloxis en paiements d’étapes potentiels, dont un paiement de 7 millions d’euros versé à la signature, ainsi que des redevances échelonnées sur les futures ventes potentielles. OSE conserve tous les droits dans les indications de maladie auto-immune.
![]() En janvier 2022, acception de la demande d’Investigational New Drug (IND) auprès de la Food & Drug Administration (FDA) obtenue par Veloxis pour un essai clinique avec VEL-101/FR104. Selon l’accord de licence, cette étape a déclenché le versement d’un paiement d’étape de 5 millions d’euros de Veloxis à OSE Immunotherapeutics.
En janvier 2022, acception de la demande d’Investigational New Drug (IND) auprès de la Food & Drug Administration (FDA) obtenue par Veloxis pour un essai clinique avec VEL-101/FR104. Selon l’accord de licence, cette étape a déclenché le versement d’un paiement d’étape de 5 millions d’euros de Veloxis à OSE Immunotherapeutics.
![]() En février 2022, obtention de la désignation « Fast Track » de la FDA par Veloxis pour le développement de VEL-101/FR104 dans la prophylaxie du rejet d’allogreffe chez des patients transplantés rénaux.
En février 2022, obtention de la désignation « Fast Track » de la FDA par Veloxis pour le développement de VEL-101/FR104 dans la prophylaxie du rejet d’allogreffe chez des patients transplantés rénaux.
![]() En avril 2021, démarrage d’un essai clinique de phase 1/2 pour évaluer la tolérance et l’immunogénicité du vaccin CoVepiT. Suite à un nombre limité d’effets indésirables de grade 1 et un effet indésirable de grade 2, la Société a décidé de suspendre volontairement le recrutement et les administrations dans l’essai et d’évaluer l’évolution de ces nodules avant de déterminer la meilleure voie à suivre pour le développement du produit dans la population ciblée.
En avril 2021, démarrage d’un essai clinique de phase 1/2 pour évaluer la tolérance et l’immunogénicité du vaccin CoVepiT. Suite à un nombre limité d’effets indésirables de grade 1 et un effet indésirable de grade 2, la Société a décidé de suspendre volontairement le recrutement et les administrations dans l’essai et d’évaluer l’évolution de ces nodules avant de déterminer la meilleure voie à suivre pour le développement du produit dans la population ciblée.
![]() En mars 2022, annonce de l’analyse positive de la réponse T immunitaire à long terme avec des résultats immunologiques positifs à 6 mois sur la réponse T mémoire chez les sujets vaccinés. En parallèle, la résolution des indurations locales liées au mécanisme d’action (1) des cellules T et un bon profil de tolérance ont été confirmés.
En mars 2022, annonce de l’analyse positive de la réponse T immunitaire à long terme avec des résultats immunologiques positifs à 6 mois sur la réponse T mémoire chez les sujets vaccinés. En parallèle, la résolution des indurations locales liées au mécanisme d’action (1) des cellules T et un bon profil de tolérance ont été confirmés.
![]() La stratégie d’OSE est maintenant de sélectionner les peptides les plus pertinents pour permettre une transposition industrielle plus simple pour pouvoir être prêts face à une autre vague pandémique liée à un nouveau variant préoccupant en particulier pour les patients immunodéprimés avec une faible réponse anticorps.
La stratégie d’OSE est maintenant de sélectionner les peptides les plus pertinents pour permettre une transposition industrielle plus simple pour pouvoir être prêts face à une autre vague pandémique liée à un nouveau variant préoccupant en particulier pour les patients immunodéprimés avec une faible réponse anticorps.
Des nouvelles données qui reflètent l’expansion et les avancées de trois programmes de développement préclinique en Immuno-Oncologie et dans l’Immuno-Inflammation présentées aux congrès 2021 de l’AACR (American Association of Cancer Research) et du SITC (Society for Immunotherapy of Cancer)
Nouvelle cible de point de contrôle myéloïde, CLEC-1 (parmi les récepteurs CLR – C-type lectin receptors), et des premiers anticorps monoclonaux antagonistes de CLEC-1 bloquant le signal « Don’t Eat Me »
![]() AACR : les données présentées montrent que CLEC-1 inhibe la phagocytose des cellules tumorales et agit en synergie avec les anticorps monoclonaux cytotoxiques, à la fois dans les tumeurs hématologiques et solides, et freine la présentation croisée des antigènes des cellules dendritiques.
AACR : les données présentées montrent que CLEC-1 inhibe la phagocytose des cellules tumorales et agit en synergie avec les anticorps monoclonaux cytotoxiques, à la fois dans les tumeurs hématologiques et solides, et freine la présentation croisée des antigènes des cellules dendritiques.
![]() SITC : OSE Immunotherapeutics et l’équipe de recherche du Dr Elise Chiffoleau* ont décrit les résultats de leur programme collaboratif. Pour la première fois, une efficacité préclinique significative des anticorps antagonistes de CLEC-1 a été démontrée in vivo et en monothérapie dans un modèle tumoral d’hépatocarcinome de souris immunocompétente.
SITC : OSE Immunotherapeutics et l’équipe de recherche du Dr Elise Chiffoleau* ont décrit les résultats de leur programme collaboratif. Pour la première fois, une efficacité préclinique significative des anticorps antagonistes de CLEC-1 a été démontrée in vivo et en monothérapie dans un modèle tumoral d’hépatocarcinome de souris immunocompétente.
![]() Centre de Recherche en Transplantation et Immunologie, UMR1064, INSERM, Nantes Université, au CHU de Nantes.
Centre de Recherche en Transplantation et Immunologie, UMR1064, INSERM, Nantes Université, au CHU de Nantes.
![]() AACR : les données présentées valident le fort potentiel thérapeutique d’une activation des signaux IL-7 pour renforcer le traitement PD-1 et prévenir l’immuno-résistance en désarmant les fonctions suppressives des cellules T régulatrices. Le bispécifique BiCKI®IL-7 variant peut préférentiellement délivrer et activer la voie IL-7 dans les lymphocytes T réactifs contre la tumeur, limitant ainsi le risque d’immunotoxicité des combinaisons d’immunothérapies.
AACR : les données présentées valident le fort potentiel thérapeutique d’une activation des signaux IL-7 pour renforcer le traitement PD-1 et prévenir l’immuno-résistance en désarmant les fonctions suppressives des cellules T régulatrices. Le bispécifique BiCKI®IL-7 variant peut préférentiellement délivrer et activer la voie IL-7 dans les lymphocytes T réactifs contre la tumeur, limitant ainsi le risque d’immunotoxicité des combinaisons d’immunothérapies.
![]() SITC : le ciblage de l’IL-7 sur les cellules T PD1+ spécifiques de la tumeur a montré la propriété unique d’induire de façon sélective l’expansion et la survie des lymphocytes T mémoires progéniteurs exprimant le marqueur TCF1+ (T Cell Factor 1) in vitro dans un modèle humain d’épuisement des cellules T et in vivo dans un modèle de tumeur chez la souris. Cette nouvelle immunothérapie empêche ainsi l’épuisement des cellules souches T réactives spécifiquement contre la tumeur, et induit ainsi une mémoire antitumorale à long terme.
SITC : le ciblage de l’IL-7 sur les cellules T PD1+ spécifiques de la tumeur a montré la propriété unique d’induire de façon sélective l’expansion et la survie des lymphocytes T mémoires progéniteurs exprimant le marqueur TCF1+ (T Cell Factor 1) in vitro dans un modèle humain d’épuisement des cellules T et in vivo dans un modèle de tumeur chez la souris. Cette nouvelle immunothérapie empêche ainsi l’épuisement des cellules souches T réactives spécifiquement contre la tumeur, et induit ainsi une mémoire antitumorale à long terme.
![]() L’article publié dans « Science Advances » est la première publication revue par des pairs à décrire un anticorps monoclonal agoniste, OSE-230, qui déclenche des mécanismes pro-résolutifs des neutrophiles et des macrophages dans un contexte d’inflammation chronique. Cette découverte ouvre à OSE-230 des pistes de développement dans plusieurs indications d’inflammation chronique comme les maladies inflammatoires de l’intestin, du poumon ou du rein, l’arthrite ou le diabète de type 1. Par ailleurs, les données présentées montrent pour la première fois le potentiel thérapeutique d’activation des programmes pro-résolutifs avec des anticorps monoclonaux agonistes anti-ChemR23 pour limiter l’inflammation chronique dans le micro-environnement tumoral et freiner le développement de métastases.
L’article publié dans « Science Advances » est la première publication revue par des pairs à décrire un anticorps monoclonal agoniste, OSE-230, qui déclenche des mécanismes pro-résolutifs des neutrophiles et des macrophages dans un contexte d’inflammation chronique. Cette découverte ouvre à OSE-230 des pistes de développement dans plusieurs indications d’inflammation chronique comme les maladies inflammatoires de l’intestin, du poumon ou du rein, l’arthrite ou le diabète de type 1. Par ailleurs, les données présentées montrent pour la première fois le potentiel thérapeutique d’activation des programmes pro-résolutifs avec des anticorps monoclonaux agonistes anti-ChemR23 pour limiter l’inflammation chronique dans le micro-environnement tumoral et freiner le développement de métastases.
![]() En janvier 2022, nomination de Dominique Costantini en qualité de Directrice générale d’OSE Immunotherapeutics suite au départ d’Alexis Peyroles.
En janvier 2022, nomination de Dominique Costantini en qualité de Directrice générale d’OSE Immunotherapeutics suite au départ d’Alexis Peyroles.
![]() En février 2022, nomination d’Alexandre Lebeaut par cooptation en qualité d’administrateur indépendant de la Société (en remplacement d’Alexis Peyroles qui a démissionné de son poste d’administrateur).
En février 2022, nomination d’Alexandre Lebeaut par cooptation en qualité d’administrateur indépendant de la Société (en remplacement d’Alexis Peyroles qui a démissionné de son poste d’administrateur).
Le Conseil d’administration d’OSE Immunotherapeutics s’est réuni le 30 mars 2022. Après avis du Comité d’audit, le Conseil a arrêté les comptes sociaux ainsi que les comptes consolidés établis en référentiel IFRS au 31 décembre 2021.
Les chiffres clés des comptes consolidés annuels 2021 sont présentés ci-dessous (et en annexe) :
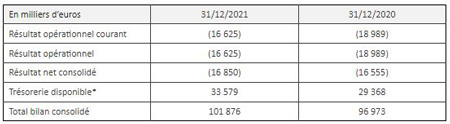
Au 31 décembre 2021, la trésorerie disponible* de la Société s’élevait à 33,6 M€ contre 29,4 M€ au 31 décembre 2020, assurant une visibilité financière jusqu’au 1ème trimestre 2023.
En 2021, OSE Immunotherapeutics a reçu :
![]() 10 M€ correspondant à la première tranche de l’emprunt BEI, d’un montant total de 25 M€ ;
10 M€ correspondant à la première tranche de l’emprunt BEI, d’un montant total de 25 M€ ;
![]() Un paiement d’étape de 8 M€ dans le cadre du contrat de licence signé avec Boehringer Ingelheim ;
Un paiement d’étape de 8 M€ dans le cadre du contrat de licence signé avec Boehringer Ingelheim ;
![]() Un paiement de 7 M€ à la signature du contrat de licence avec Veloxis ;
Un paiement de 7 M€ à la signature du contrat de licence avec Veloxis ;
![]() Un paiement de 5,6 M€ de la part de Bpifrance pour financer le développement de CoVepiT ;
Un paiement de 5,6 M€ de la part de Bpifrance pour financer le développement de CoVepiT ;
![]() Un paiement d’étape de 5 M€ dans le cadre d’un contrat de licence avec option signé avec Servier ;
Un paiement d’étape de 5 M€ dans le cadre d’un contrat de licence avec option signé avec Servier ;
![]() Un paiement d’étape de 1,3 M€ de la part de Bpifrance dans le cadre du programme collaboratif EFFIMab pour le produit OSE-217/S95011.
Un paiement d’étape de 1,3 M€ de la part de Bpifrance dans le cadre du programme collaboratif EFFIMab pour le produit OSE-217/S95011.
Cette trésorerie a été renforcée sur le premier trimestre 2022 par :
![]() 5 M€ suite à l’obtention de l’obtention de l’IND aux Etats-Unis par la société Veloxis pour le FR104 dans le domaine de la greffe ;
5 M€ suite à l’obtention de l’obtention de l’IND aux Etats-Unis par la société Veloxis pour le FR104 dans le domaine de la greffe ;
Et devrait être renforcée dans les prochains mois par :
![]() Le Crédit d’impôt recherche d’un montant de 4,3 M€ ;
Le Crédit d’impôt recherche d’un montant de 4,3 M€ ;
![]() D’autres paiements d’étapes attendus de nos partenaires, selon l’avancée des programmes.
D’autres paiements d’étapes attendus de nos partenaires, selon l’avancée des programmes.
Cette trésorerie permettra à la Société de financer les coûts de développement de ses produits en clinique et en R&D pour ses produits au stade plus précoce
En 2021, OSE Immunotherapeutics a enregistré un résultat opérationnel consolidé de -16.6 M€. Les charges courantes d’exploitation s’élevaient à 42,9 M€ (contre 29,4 M€ en 2020) dont 75 % dédiés à la R&D. Les dépenses de R&D s’élevaient à 30,6 M€.
*Trésorerie et équivalents trésorerie et Actifs financiers courants.